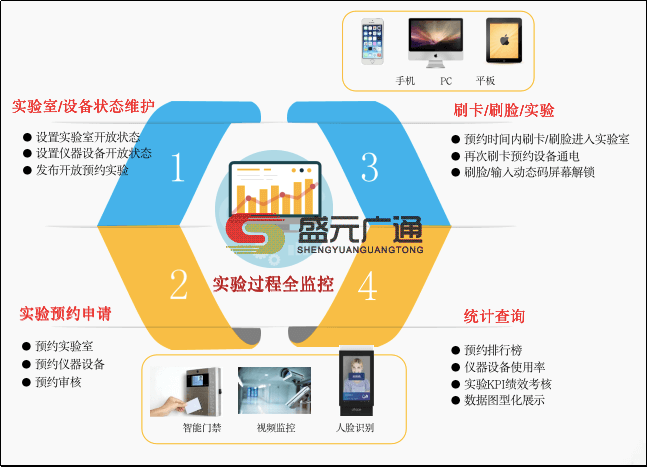
医疗实验室如何通过LIMS实现药品记录与数据规范管理
2020-03-12 09:53
近年来,国家对药品监管越来越重视,出台的一系列法律法规中,关于药品非临床研究与药品临床试验的规范越来越详细。NMPA曾三次为《药品数据管理规范》公开征求意见,2020年2月28日,再次为《药品记录与数据管理规范》(以下简称“规范”)公开征求意见,更加明确提出规范的记录与数据的管理,注重从源头开始保证药品质量安全;同时,为更好满足和指导监督需要,提出实验室电子记录可代替纸质记录,这样既能提升企业效率,也可方便监管,甚至对部分监管内容而言,远程监管将成为一种可能。
第一章 总则
第一条:为规范药品研制、生产、经营和使用活动的记录与数据管理,根据《中华人民共和国药品管理法》《中华人民共和国疫苗管理法》等相关法律法规,制定本规范。
药品研发改成研制,说明突出药物研究需更有应用目的性;使用活动则将药品整个生命周期包含在本规范适用范围中,进一步提高药品安全性保障。
第二条:药品研制、生产、经营和使用活动中产生的依法需要向药品监督管理部门提供的记录与数据,适用本规范。
很多时候,CDE不会对每个项目进行详细审查,一是人员限制,二是没有合适方式查询监管,比如目前已取消GMP、GSP认证。但国家也没发布详细监管措施。可见,国家正在探讨一种全新的,更完善的监管方式,目的是既方便监管,又做到监管更加完善。因此本条规范想要表达的内容不仅是向CDE提交的记录与数据要遵循本规范,更是要把所有产生的数据与记录做到完整、准确、真实、可追溯,为将来的监管要求提前准备。
第二章 记录与数据管理基本原则
第三条:数据是指在药品研制、生产、经营和使用活动中产生的反映活动执行情况的信息,包括:数值、符号、影像、音频、图片、图谱、条码等;记录是指在上述活动中通过一个或多个数据记载所形成的,反映相关活动执行过程与结果的凭证。
数据方面,实验室信息化管理LIMS系统中物资信息、仪器信息、人员信息、项目信息、环境信息中所包含的文字,图文信息基本信息,同时在研制过程中产生的一系列信息,统称数据。
记录方面:LIMS系统中以项目管理为主脉络,通过ELN将各模块(如人、机、料、法、环、QC等)串联,将实验中所用的物资、仪器、实验方法、人员情况、环境情况,审核情况进行记录,此记录可作为实验过程与结果的凭证。
第四条:从事药品研制、生产、经营和使用活动,应当依法制订业务管理规程,明确记录管理要求,保证全过程信息真实、准确、完整和可追溯。
真实性与准确性,LIMS数据人工输入、自动采集都需要进行二次审批,保证数据真实性与准确性。
完整性,LIMS中,物资采购、用处、库存、损耗、报废全生命周期记录,仪器采购、维护、校准、检验,试用记录、SOP、借用数据记录等。
可追溯性,所有操作将有电子记录留痕,并且此类电子记录不能更改,如物资使用,可查询到用于ELN中哪次实验中。
第五条:记录可以分为台账类、日志类、标识类、流程类、报告类等,根据业务活动的要求,活动主体可以采用一种或多种记录类型,证明活动过程信息真实、准确、完整和可追溯。记录载体可采用纸质、电子或混合等一种或多种形式。
台账类:物资领取情况,仪器使用情况作为电子台账记录。
日志类:操作过程,登录过程、校准行为、检查行为都将记录在日志类中。
标识类:物资、仪器标签,系统生成,手持扫描枪可进行出入库管理。
流程类:项目申请,物资申领,仪器预约,实验记录审批等流程电子记录。
报告类:物资使用、项目情况、人工工时、项目完成、项目进度等多维度报告。
对于报告类型作出了详细的指定,给手动记录,保存,管理带了不小工作压力,信息化系统可大大简化工作量,节约成本。
第六条:采用计算机(化)系统生成记录或数据的,应当采取相应的管理措施与技术手段,确保生成的电子记录及数据真实、准确、完整和可追溯。
LIMS系统需通过CSV(计算机化系统)认证,有详细的验证文件,URS,风险管理文档,电子签名授权书等,使用全生命周期方法,确保良好质量管理体系、计算机化系统符合法规、符合指定用途。
第七条:电子记录至少应当实现原有纸质记录同等功能,满足业务活动管理要求。对于电子记录和纸质记录并存的情况,应当明确基准记录的形式。
21 CFR part 11规定,电子记录与纸质同时存在时,以无纸化电子记录为主。
第八条:记录管理应当制定业务管理规程,明确记录管理责任,规范记录的控制方法。
药物研究实验室按照人员职责,设定角色权限,并通过SOP,责任到人,规范记录。
第九条:数据的采集、处理、存储、生成、检索、报告等活动,应当满足相应数据类型的记录填写或数据录入的要求,保证数据真实、准确、完整和可追溯。
LIMS活动根据实际业务流程打造,将数据活动形成一套可配置的规则,确保数据是根据预期设定目标进行输入输出。
第十条:根据数据的来源与用途,可将数据分为基础信息数据、行为活动数据、计量器具数据、电子数据及其它类型数据,不同类型的数据应采用适当的管理措施与技术手段。
LIMS作为计算机化系统的一部分,可将计算机系统内各类型数据进行记录,同时也可与计量器具等其他数据进行关联。
第十一条:从事记录管理的人员应当接受必要的培训,掌握记录管理要求与操作技能,遵守职业道德守则。
LIMS系统中嵌入培训功能,将培训课程、考题、考试情况结合在一起,以权限控制方式,对没有通过培训学习或者培训完考试未及格人员进行权限控制。
第十二条:通过合同约定由第三方产生的记录与数据,应当符合本规范要求并明确合同各方的管理责任。
第三方产品,如液相,需支持通过3Q认证,实验室信息化管理系统具有稳定性。